- 上海中申國際貿易有限公司,20年外貿進出口代理服務經驗。
- 服務熱線:139 1787 2118
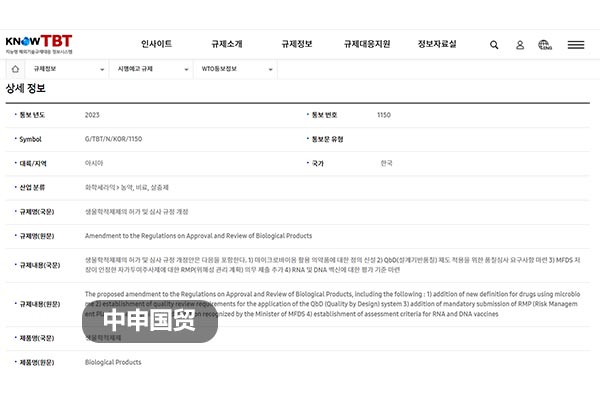
2023年6月26日,韓國食品藥品安全部(MFDS)向WTO報送G/TBT/N/KOR/1150號通知,計劃對《生物制劑等品種許可、審查規定》進行修訂。修訂目標是為了進一步加強國內生物制劑的安全。截至2023年8月25日,此修訂正在征求意見階段。
我國是全球第二大生物制劑市場,且相關產品的出口規模逐年遞增,僅2022年我國對韓國出口醫藥產品就達到了12.57億美元。當前韓國為我國"西藥制劑”第一出口大國,因此此次修訂對我國出口企業影響重大。建議出口企業應高度關注此次修訂的內容更改,及時調整產品策略,避免后續出口產生不必要的貿易損失。
修訂內容概述:
(1)新詞義定義:為新出現的活菌制劑等名詞定義;
(2)質量體系審查要求:制定了適用于設計質量體系(QbD)的質量審核要求(方案第4條、第26條);
(3)"科學論文引用索引”范圍擴大:擴大了被認定為藥理作用和臨床試驗效果資料的"科學論文引用索引”范圍(方案第7條);
(4)改善穩定性試驗資料的提交條件:對變更制造方法時,改善穩定性試驗資料的提交條件進行了更改;
(5)風險管理計劃提交程序:對于MFDS認可的自行注射產品,新增了強制性提交風險管理計劃(RMP)的程序;
(6)RNA和DNA疫苗評價標準:建立了RNA和DNA疫苗評價標準。
相關推薦
聯系我們
電話:139-1787-2118
郵箱:service@sh-zhongshen.com
郵箱:service@sh-zhongshen.com
相關推薦
微信聯系

? 2024. All Rights Reserved. 滬ICP備2023007705號-2  滬公網安備31011502009912號
滬公網安備31011502009912號